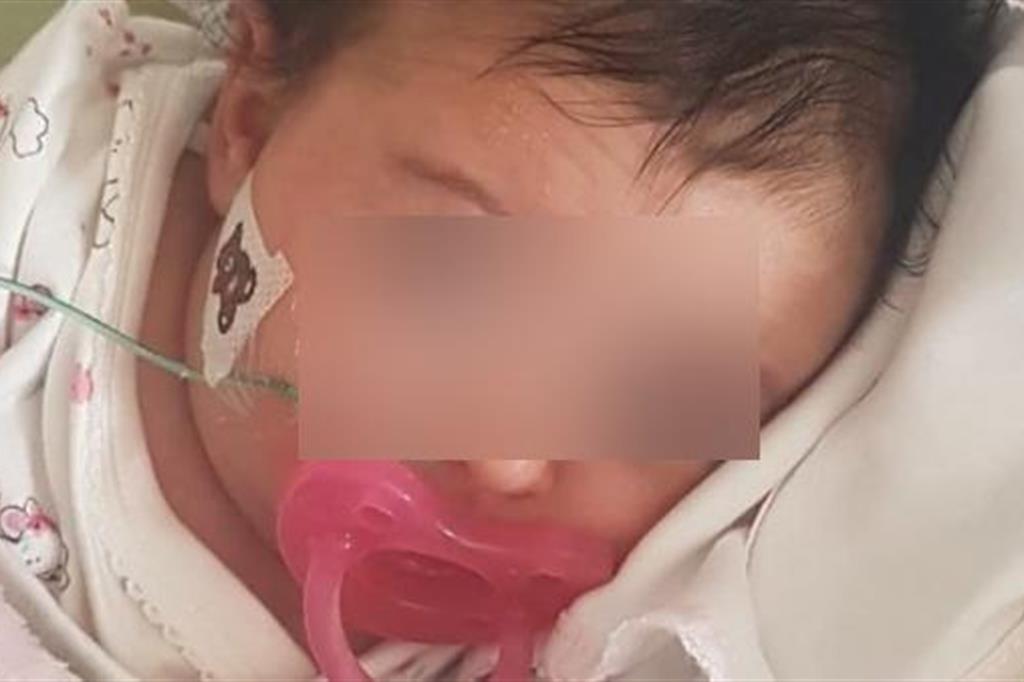
La piccola Matilde
Un’impressionante ondata di solidarietà ha percorso il Portogallo per salvare la piccola Matilde. La bimba di meno di due mesi, con grandi occhi aperti sul mondo, è affetta da atrofia muscolare spinale di tipo 1, la forma più grave di tale malattia. Essa colpisce i muscoli del corpo, provoca perdita delle capacità motorie e paralisi progressiva.
Dopo un appello in tv e una catena sulle reti sociali, che hanno scatenato fra i portoghesi una gara di generosità con pochi precedenti, i suoi genitori sono riusciti a raccogliere in tempo record – meno di due mesi – i 2 milioni di euro necessari per il trattamento “one-shot” del «farmaco più costoso del mondo», che potrebbe dare alla piccola Matilde una vita normale. È il Zolgensma, finora l’unico medicamento genetico per minori di due anni con Ema, approvato a maggio negli Stato Uniti e commercializzato da Novartis al costo di 1,9 milioni di euro. A dare l’annuncio dell’obiettivo raggiunto sono stati i genitori su Facebook, dove hanno condiviso la foto della “bebè speciale”, ricoverata in terapia intensiva all’ospedale Santa Maria di Lisbona, e gli aggiornamenti sul suo stato di salute. Assieme all’emozione per le donazioni che regalano a Matilde la speranza di un’aspettativa di vita più lunga, senza dipendere per sempre da un respiratore artificiale.
«Non esistono parole nel dizionario per descrivere tutto quello che avete fatto per noi. La somma che non verrà utilizzata per Matilde sarà donata alle famiglie con altre Matilde» con lo stesso problema, il messaggio postato.
Il passo successivo sarà stabilizzare la bimba, che ha problemi respiratori. Non è facile trasferirla negli Stati Uniti per la terapia del Zolgensma, che avrebbe già avuto effetti positivi su 19 bambini come lei. In Europa, però, il farmaco non ha ancora ricevuto l’autorizzazione dall’Agenzia Europea per i farmaci (Ema).
Intanto, nella mobilitazione generale per Matilde, Infermed, la National medicine authority, sta studiando con il ministero della Salute portoghese e l’ospedale Santa Maria una soluzione per la somministrazione del farmaco in loco, possibile secondo il regolamento solo «in casi eccezionali», nel rispetto delle procedure e «in mancanza di un’alternativa terapeutica». Ma non quando non abbiano ottenuto il via libera dall’Ema. E, fino a ieri, nessuna decisione era stata presa. Secondo fonti mediche, però, il farmaco potrebbe arrivare in Europa alla fine del 2019.







.jpg?dt=1734793081845&Width=300)
.jpg?dt=1734793081845&width=677)

